
Агуулгын хүснэгт:
- Зохиолч Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Хамгийн сүүлд өөрчлөгдсөн 2025-01-22 17:05.
12.38 Хос бүрийн аль нь байна нь илүү өндөр уурын даралт (a) C2H6 эсвэл C4H10 : C2H6 байна нь илүү өндөр уурын даралт. Зөвхөн тархалтын хүчнүүд байдаг бөгөөд эдгээр нь илүү хүнд хүчтэй байдаг C4H10 молекул. Энэ мэт тохиолдолд илүү хүнд молекулууд, аль байна илүү хүчтэй тархалтын хүч, хүсэл байна нь илүү өндөр буцалгах цэг.
Иймээс c3h8 эсвэл c4h10 нь буцалгах цэг өндөртэй юу?
C2H6 < C3H8 < C4H10 . Эдгээр бүх нэгдлүүд нь туйлт биш бөгөөд зөвхөн байна Лондонгийн тархалтын хүч: молекул их байх тусам тархалтын хүч их байх болно илүү өндөр нь буцлах цэг.
Үүний нэгэн адил аль нь илүү өндөр буцалгах цэгтэй байх вэ? Молекул хоорондын дөрвөн хүчний харьцангуй хүч нь: Ионы > Устөрөгчийн холбоо > Диполь диполь > Ван дер Ваалсын дисперсийн хүч. Эдгээр татах хүч бүрийн нөлөө болно одоо байгаа функциональ бүлгүүдээс хамаарна. Буцлах цэгүүд нүүрстөрөгчийн тоо нэмэгдэх тусам нэмэгддэг.
Мөн та аль нэгдэл нь илүү өндөр буцалгах цэгтэй байх ёстойг мэдэх үү?
Молекул хоорондын хүч илүү хүчтэй байх тусам илүү өндөр нь буцлах цэг . Ерөнхийдөө устөрөгчийн холбоо нь диполь-диполь таталтаас илүү хүчтэй байдаг байна Лондонгийн тархалтын хүчнээс илүү хүчтэй.
Буцлах цэгийг хэрхэн тодорхойлох вэ?
Буцлах цэгийн өргөлтийн жишээ
- Глюкоз бол бидний уусгагч, ус бол уусгагч юм.
- Усны хувьд Kb нь 0.51 градус Цельсийн кг / моль.
- Глюкозын молийн масс нь 180 г / моль юм.
- Усны буцлах цэг нь 100 хэм байна.
- Буцлах цэгийн өргөлтийн тэгшитгэл нь дельта T = mKb байна.
Зөвлөмж болгож буй:
Этан эсвэл этен илүү өндөр буцалгах цэгтэй юу?

Этан нь этенээс илүү хүчтэй молекул хоорондын таталцлыг (ван дер Ваалын хүч) агуулдаг тул буцлах цэг нь өндөр байдаг
Этанол эсвэл ацетон илүү өндөр буцалгах цэгтэй юу?

Тиймээс этанол (H-холбох хүчин чадалтай) хамгийн их буцлах цэгтэй байх ёстой бөгөөд туйлын ацетон дараагийн хамгийн өндөр буцлах цэгтэй байх ба молекул хоорондын хамгийн сул хүч бүхий полярпропан нь хамгийн бага буцалгах цэгтэй байх ёстой. 41
Метан буцалгах цэг хэд вэ?

161.5 ° C
Ус буцалгах нь химийн эсвэл физикийн өөрчлөлт үү?

Буцалж буй ус Усны уур нь шингэн устай (H2O) ижил молекулын бүтэцтэй хэвээр байгаа тул буцалж буй ус нь химийн өөрчлөлт биш физик өөрчлөлтийн жишээ юм. Хэрэв бөмбөлөгүүд нь молекулын хий болон задралын улмаас үүссэн бол (H2O → H2 ба O2 гэх мэт) буцалгах нь химийн өөрчлөлт байх болно
Ус яагаад буцлах, хайлах цэг өндөртэй байдаг вэ?
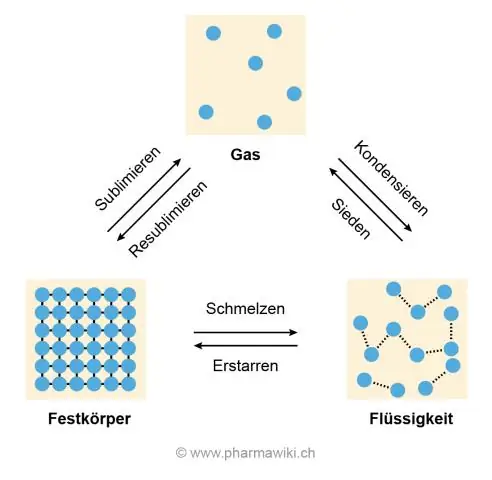
Өндөр хайлах, буцалгах температурын шалтгаан нь усны молекулуудын хоорондох устөрөгчийн холбоо бөгөөд тэдгээр нь хоорондоо наалдаж, салахыг эсэргүүцдэг бөгөөд энэ нь мөс хайлж, ус буцлах үед хий болж хувирдаг
