
- Зохиолч Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Хамгийн сүүлд өөрчлөгдсөн 2025-06-01 05:05.
Тэнд дөрөв байна боломжит хослолууд төлөө l-ийн утгууд ба м л хувьд = 2 . = 2 Үндсэн энергийн түвшинд s орбитал ба p орбитал орно.
Мөн n 5 байхад L ба ML-ийн утгуудын хэд хэдэн боломжит хослол байж болох вэ?
Хариулт ба тайлбар: Хэзээ = 5 л 0, 1 эсвэл 2 байж болно. Эдгээр үнэт зүйлс s, p, d, f орбиталуудтай тохирно. М l утгууд -3-аас +3 хооронд хэлбэлздэг.
Үүнтэй адилаар энэ тойрог замын хувьд L-ийн боломжит утгууд хэд вэ? Жишээлбэл, s-ийн хувьд тойрог зам , л = 0 ба m-ийн цорын ганц утга л тэг байна. p орбиталуудын хувьд, л = 1 ба m л -1, 0 эсвэл +1-тэй тэнцүү байж болно. Ерөнхийдөө М л тэнцүү байж болно - л , -( л - 1), …, -1, 0, +1, …, ( л - 1), л . Нийт тоо боломжтой -ийн ижил утгатай тойрог замууд л (дэд бүрхүүл) нь 2л + 1 байна.
Үүний дагуу n-ийн утга бүрийн хувьд L-ийн боломжит утгууд хэд вэ?
Учир нь =3, нь l-ийн боломжит утгууд = 0, 1, 2 бөгөөд энэ нь -ийн хэлбэрийг заана тус бүр дэд бүрхүүл.
- n = 1-тэй үндсэн бүрхүүл нь нэг дэд бүрхүүлтэй (l = 0)
- n = 2-той үндсэн бүрхүүл нь нэг s дэд, нэг p дэд бүрхүүлтэй (l = 0, 1)
- n = 3-тай үндсэн бүрхүүл нь нэг s дэд бүрхүүл, нэг p дэд бүрхүүл, нэг d дэд бүрхүүлтэй (l = 0, 1, 2)
Хэзээ N 4 L-ийн боломжит утгууд хэд вэ?
Хариулт ба тайлбар: Н = 4 , the l-ийн боломжит утгууд нь 0, 1, 2, ба 3. Хэрэв л = 0, the боломжтой m_l-ийн утга 0 байна.
Зөвлөмж болгож буй:
Далайн хорхой хэр олон удаа иддэг вэ?

Хөдөлгөөн нь ерөнхийдөө хооллолттой холбоотой бөгөөд улаач (Mesocentrotus franciscanus) хоол хүнс ихтэй үед өдөрт ойролцоогоор 7.5 см (3 инч), хоолгүй газарт 50 см (20 инч) хүртэл хөдөлдөг
Давхардсан шугамууд хэр олон шийдэлтэй вэ?

Шугаман тэгшитгэлийн систем нь зөвхөн 0, 1 эсвэл хязгааргүй тооны шийдтэй байж болно. Энэ хоёр шугам хоёр удаа огтлолцож болохгүй. Зөв хариулт бол системд нэг шийдэл байдаг. 2 оноотой сагсны тоо 3 оноотой сагсны тоо 1 0 2 1 3 2 4 3
Нарны бүтэн хиртэлт хэр олон удаа тохиолддог вэ?

Нарны бүтэн хиртэлт нь ховор тохиолддог үзэгдэл юм. Тэд дэлхийн хаа нэгтээ дунджаар 18 сар тутамд тохиолддог боловч дунджаар 360-410 жилд нэг л удаа ямар ч газарт давтагддаг гэсэн тооцоо байдаг
Паркфилд хэр олон удаа газар хөдлөлт болдог вэ?

Дор хаяж 1857 оноос хойш Паркфилд 22 жил тутамд 6 ба түүнээс дээш магнитудын хүчтэй газар хөдлөлтийг амсдаг
Аль хуваагдлын үед мейозын үед хромосомын тоо багасдаг вэ?
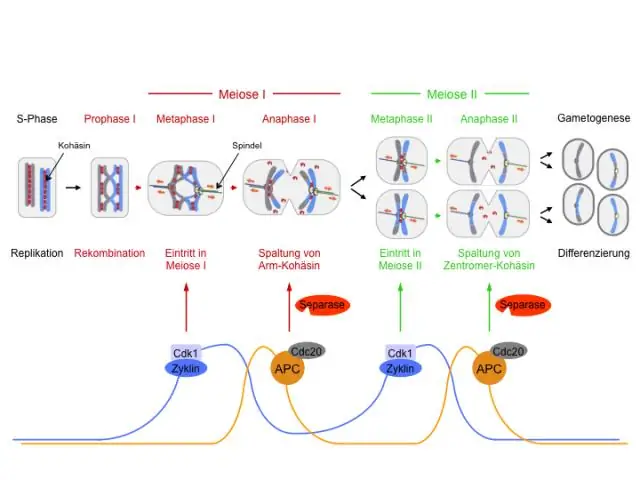
Эхний хуваагдал нь хромосомын тоог 46 хромосомоос 23 хромосом буюу n хүртэл бууруулдаг (n нь нэг хромосомын багцыг дүрсэлдэг) учир багасгах хуваагдал буюу мейоз I гэж нэрлэгддэг
