
- Зохиолч Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Хамгийн сүүлд өөрчлөгдсөн 2025-01-22 17:05.
А-ийн жишээг авч үзье буфер сул баазаас бүрддэг аммиак , NH3 ба түүний коньюгат хүчил NH4+. Хэзээ HCl (хүчтэй хүчил) үүн дээр нэмнэ буфер системд нэмэлт H+ ионуудыг системд зарцуулдаг NH3 руу хэлбэр NH4+. Дараа нь хүчил эсвэл суурь нэмсэн буфер рН хурдан өөрчлөгдөнө.
Үүний нэгэн адил nh3 ба NH4Cl нь буфер уусмал мөн үү?
Хариулт ба тайлбар: Аммиак ба аммонийн хлорид буфер сул хүчил ба түүний давсны холимог юм. Энэ нь суурь юм буфер Учир нь аммиакийн суурийн диссоциацийн тогтмол нь аммонийн ионуудын хүчиллэгийн тогтмолоос их байдаг.
Үүний нэгэн адил, HCl ба nh3 ямар төрлийн урвал вэ? Тиймээс NH3 -ийн H+ хүлээн авах тухай HCl (H+ ба Cl-) нь Cl- ионтой холбогдон NH4+ (аммонийн ион) үүсгэдэг. HCl ) NH4Cl (аммонийн хлорид) өгдөг. The урвал хэлбэрээр илэрхийлэгддэг NH3 + HCl = NH4Cl.
HCl-ийг аммиакийн буферт нэмэхэд ямар урвал гарах вэ?
Давсны давс хүчил аммиактай хүчтэй урвалд орж аммонийн хлорид (энэ нь маш бага хүчиллэг, ерөнхийдөө хор хөнөөлгүй давс) үүсгэж, уусмалын суурь чанарыг саармагжуулж, устөрөгчийн хийн бөмбөлөгүүд эрчимтэй үүсч, уусмалын хөөс үүсэх болно.
Аммиакийн буферийн уусмалыг яаж хийх вэ?
Аммиак - аммонийн хлорид Буфер : 67.5 г аммонийн хлоридыг 200 мл орчим усанд уусгаж, 570 мл хүчтэй уусмал нэмнэ. аммиакийн уусмал ба 1000 мл хүртэл усаар шингэлнэ. Аммиакийн буфер рН 9.5: 33.5 г аммонийн хлоридыг ISO мл усанд уусгана, 42 мл 10М. аммиак ба 250 мл хүртэл усаар шингэлнэ.
Зөвлөмж болгож буй:
Аль шийдэл нь буфер вэ?

Буфер уусмал нь бага хэмжээний хүчил эсвэл шүлт нэмэхэд рН-ийн өөрчлөлтийг эсэргүүцдэг уусмал юм. Хүчиллэг буферийн уусмалууд. Хүчиллэг буферийн уусмал нь рН нь 7-оос бага байдаг. Хүчиллэг буферийн уусмалыг ихэвчлэн сул хүчил ба түүний давсны нэг буюу натрийн давсаас бүрдүүлдэг
Цусан дахь гол буфер систем юу вэ?

Цус. Хүний цус нь цусны рН-ийг 7.35-7.45 хооронд байлгахын тулд нүүрстөрөгчийн хүчил (H 2CO 3) ба бикарбонатын анионы (HCO 3 -) буферийг агуулдаг тул 7.8-аас дээш буюу 6.8-аас доош байвал үхэлд хүргэдэг
Яагаад буфер нь pKa ойролцоох рН-д хамгийн сайн ажилладаг вэ?
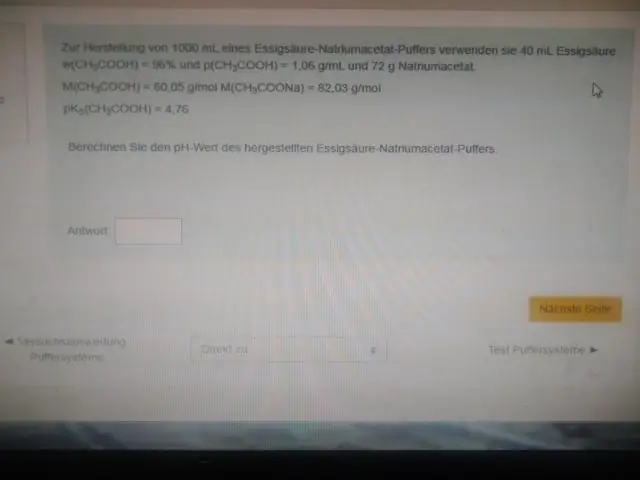
Өөрөөр хэлбэл, хүчлийн эквимоляр уусмалын рН (жишээлбэл, хүчил ба коньюгат суурийн концентрацийн харьцаа 1: 1 байх үед) pKa-тай тэнцүү байна. Энэ бүс нь хүчил эсвэл суурь нэмэхэд рН-ийн их хэмжээний өөрчлөлтийг эсэргүүцэх хамгийн үр дүнтэй байдаг. Титрлэлтийн муруй нь буферийн багтаамжийг нүдээр харуулдаг
Ихэнх буфер системийн рН-ийн хүрээ хэд вэ?

Бие махбодид цус болон бусад шингэний рН-ийг рН 7.35-аас 7.45 хооронд байлгахад тусалдаг олон төрлийн буферийн системүүд байдаг. Буфер нь илүүдэл устөрөгч эсвэл гидроксил ионыг шингээх замаар шингэний рН-ийг эрс өөрчлөхөөс сэргийлдэг бодис юм
Хүчтэй хүчил ба сул суурь нь буфер үүсгэж чадах уу?

Уусмалын рН-ийг тооцоолохдоо рН-ийг эрс өөрчлөхөд зөвхөн бага хэмжээний хүчтэй хүчил хэрэгтэй гэдгийг та харсан. Буфер нь сул хүчил ба түүний коньюгат суурь эсвэл сул суурь ба коньюгат хүчлийн холимог юм. Буфер нь рН-ийг хянахын тулд нэмэлт хүчил эсвэл суурьтай урвалд орж ажилладаг
